1. Giới thiệu
Chuẩn độ là một phương pháp định lượng phổ biến trong hóa học phân tích, dùng để xác định nồng độ của một chất chưa biết (chất phân tích) bằng cách thực hiện phản ứng với một chất trong dung dịch có nồng độ đã biết (chất chuẩn). Các phương pháp chuẩn độ cổ điển thường dựa vào sự thay đổi màu sắc của chất chỉ thị để nhận biết điểm cuối của phản ứng. Tuy nhiên, việc này có thể gặp khó khăn trong nhiều trường hợp như: (1) dung dịch có màu hoặc đục; (2) không có chất chỉ thị phù hợp; (3) cần độ chính xác cao; (4) khó tự động hóa hoàn toàn với chất chỉ thị màu.
Phương pháp chuẩn độ điện thế ra đời nhằm giải quyết những thách thức mà các kỹ thuật chuẩn độ truyền thống, vốn dựa vào sự thay đổi màu sắc của chất chỉ thị, thường gặp phải. Thay vì phụ thuộc vào việc quan sát màu sắc, phương pháp này theo dõi sự thay đổi điện thế của một điện cực được nhúng trực tiếp trong dung dịch chất phân tích. Khi chất chuẩn được thêm vào từng lượng nhỏ, điện thế của dung dịch sẽ thay đổi dần. Dựa vào sự thay đổi đột ngột của điện thế sẽ chỉ ra điểm tương đương, tức là điểm mà lượng chất chuẩn vừa đủ để phản ứng hoàn toàn với chất phân tích.
2. Nguyên lý
Phương pháp chuẩn độ điện thế hoạt động dựa trên nguyên tắc đo điện thế của một tế bào điện hóa trong quá trình phản ứng chuẩn độ. Một tế bào điện hóa trong chuẩn độ điện thế thường bao gồm:
- Điện cực chỉ thị (Indicator Electrode): Điện cực này nhạy với nồng độ của một ion cụ thể (chất phân tích hoặc một ion liên quan đến phản ứng) trong dung dịch.
+ Chuẩn độ acid-base: Điện cực thủy tinh (pH electrode) là phổ biến nhất, nhạy với nồng độ H+.
+ Chuẩn độ oxi hóa-khử: Điện cực platin (Pt) hoặc vàng (Au) thường được sử dụng.
+ Chuẩn độ kết tủa: Điện cực ion chọn lọc (ISE) như điện cực bạc (Ag) cho chuẩn độ halide.
+ Chuẩn độ phức chất: Thường sử dụng ISE cho ion kim loại
- Điện cực so sánh (Reference Electrode): Điện cực này có điện thế ổn định và không thay đổi trong suốt quá trình chuẩn độ, bất kể thành phần của dung dịch chất phân tích. Các điện cực so sánh phổ biến bao gồm điện cực calomel bão hòa (SCE) và điện cực bạc/bạc clorua (Ag/AgCl).
- Máy đo điện thế (potentiometer hoặc pH-meter) sẽ đo hiệu điện thế giữa điện cực chỉ thị và điện cực so sánh. Giá trị điện thế này được ghi lại sau mỗi lần thêm một lượng chất chuẩn.
Khi chất chuẩn được thêm vào, nồng độ của chất phân tích (hoặc các ion liên quan) sẽ thay đổi. Sự thay đổi này làm cho điện thế của điện cực chỉ thị thay đổi theo. Tại hoặc gần điểm tương đương, nồng độ của ion liên quan sẽ thay đổi đột ngột, dẫn đến sự thay đổi lớn và nhanh chóng về điện thế. Điều này tạo ra một "bước nhảy" rõ rệt trên đường cong chuẩn độ.
3. Hình ảnh thực nghiệm 

Hình 1. Bố trí thí nghiệm chuẩn độ điện thế bán tự động (máy đo thế, pH)
(Chụp ở PTN. Khoa Công nghệ Hoá học-Trường ĐH Công thương Tp.HCM)


Hình 2. Máy chuẩn độ điện thế tự động SI Analytic™ TitroLine™ 7000
(Chụp ở PTN. Trung tâm thí nghiệm thực hành-Trường ĐH Công thương Tp.HCM)


Hình 3. Sinh viên 13DHHH1 (Chuyên ngành Kỹ thuật phân tích và đảm bảo chất lượng) thao tác trên máy chuẩn độ điện thế tự động SI Analytic™
(Chụp ở PTN. Trung tâm thí nghiệm thực hành-Trường ĐH Công thương Tp.HCM)

Hình 4. Sinh viên 13DHHH1 (Chuyên ngành Kỹ thuật phân tích và đảm bảo chất lượng) trong giờ học Thực hành Phân tích điện hoá
(Chụp ở PTN. Khoa Công nghệ Hoá học-Trường ĐH Công thương Tp.HCM)
4. Kết quả thực nghiệm của sinh viên
4.1. Chuẩn độ CH3COOH bằng NaOH
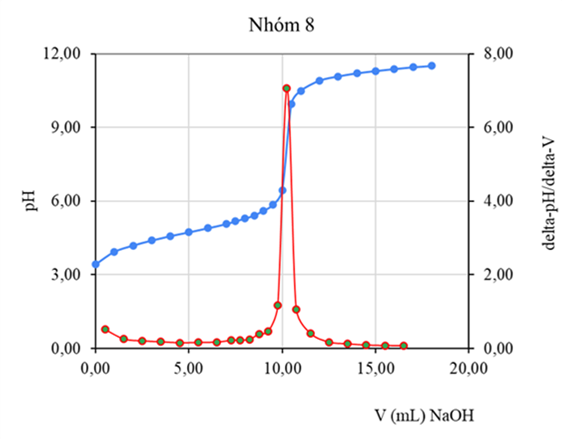
Hình 5. Đường cong pH=f(V), đạo hàm bậc 1 (DpH/DV=f(Vtb))-(chuẩn độ điện thế bán tự động)
(Số liệu thu thập từ kết quả thực hành của lớp13DHHH1-Nhóm 2
Chuyên ngành Kỹ thuật phân tích và đảm bảo chất lượng)
4.2. Chuẩn độ HCl bằng NaOH 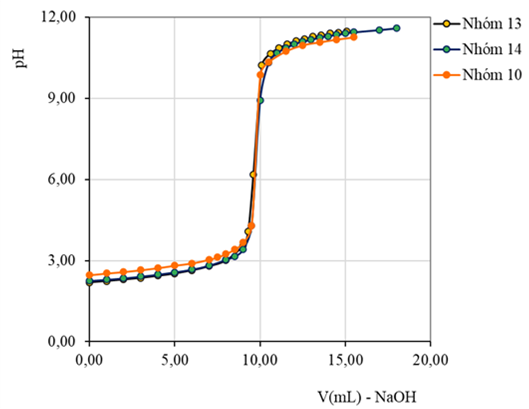
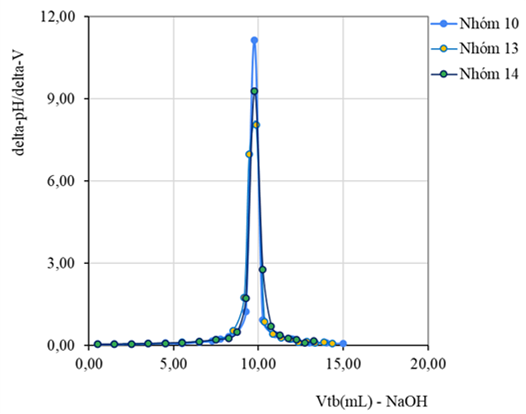
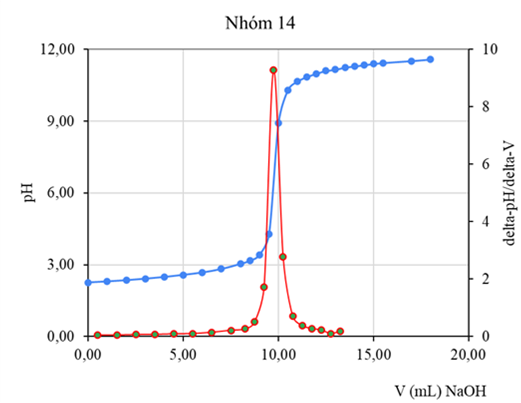
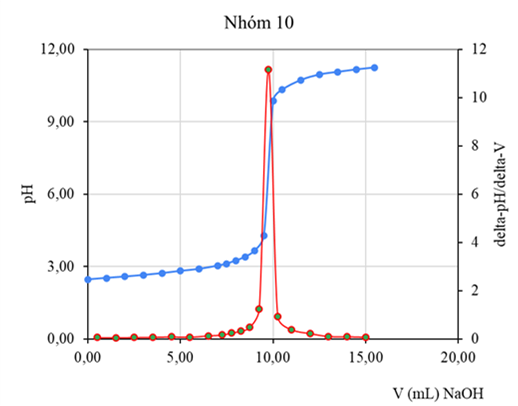
Hình 6. Đường cong pH=f(V), đạo hàm bậc 1 (DpH/DV=f(Vtb))-(chuẩn độ điện thế bán tự động)
(Số liệu thu thập từ kết quả thực hành của lớp13DHHH1-Nhóm 2
Chuyên ngành Kỹ thuật phân tích và đảm bảo chất lượng)
4.3. Chuẩn độ hỗn hợp gồm HCl và CH3COOH bằng NaOH 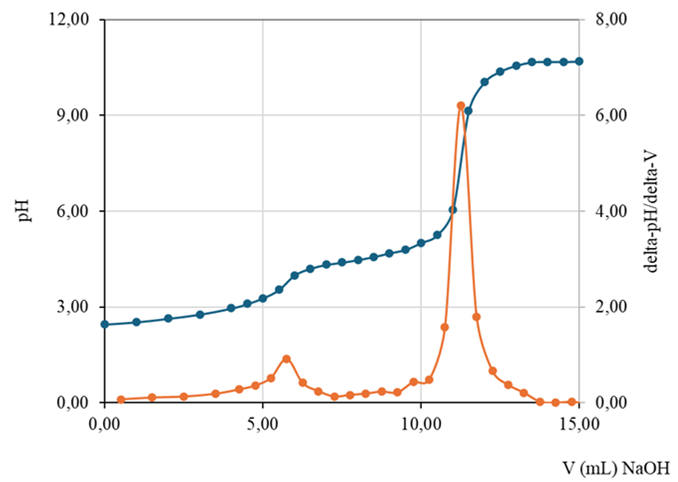
Hình 7. Đường cong pH=f(V), đạo hàm bậc 1 (DpH/DV=f(Vtb))-(chuẩn độ điện thế bán tự động)
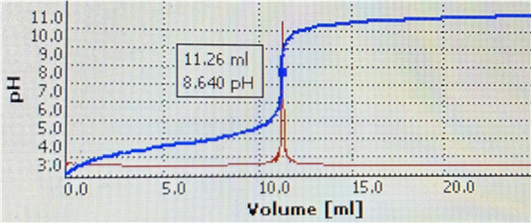
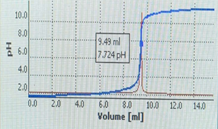
Hình 8. Kết quả chuẩn độ HCl bằng NaOH
(máy chuẩn độ điện thế tự động SI Analytic™ TitroLine™ 7000)
Nguồn tham khảo
[1]. Joseph Wang, Analytical electrochemistry, Second Edition, 2001.
[2]. Nguyễn Thanh Khuyến, Nguyễn Phước Thành, Phân tích điện hóa, Tủ sách Đại học tổng hợp TP.HCM, 1993.
[3]. Dương Quang Hùng, Một số phương pháp phân tích điện hoá, NXB ĐH Sư phạm TP.HCM, 2008.
[4]. Từ Văn Mặc, Phân tích hóa lý, NXB Khoa học và kỹ thuật Hà Nội, 1995.
Xem thêm :
- Trường Đại học Công Thương TP. HCM áp dụng Quy đổi chứng chỉ ngoại ngữ thành điểm xét tuyển môn Tiếng Anh
- Quyết định về việc chi tiền học bổng và các khoản hỗ trợ sinh viên năm học 2025-2026
- Kế hoạch tổ chức triển khai công tác tuyển sinh đại học chính quy năm 2025
- Biểu mẫu tuyển sinh đại học năm 2025
- Thông tin tuyển sinh Đại học năm 2025



