Trong thập kỷ qua, sự bùng nổ của công nghệ nano đã mở ra những cơ hội vượt bậc trong các lĩnh vực từ y học, điện tử đến xử lý môi trường. Vật liệu nano có khả năng thao tác và điều chỉnh các đặc tính vật lý–hóa học ở quy mô nguyên tử và phân tử, cho phép tạo ra các sản phẩm với hiệu năng vượt trội. Tuy nhiên, bởi vì sự khác biệt về kích thước, diện tích bề mặt và khả năng tương tác với các hệ thống sinh học, vật liệu nano cũng dấy lên nhiều lo ngại liên quan đến độc tính và tác động lâu dài đến sức khỏe con người [1,2].
Vật liệu nano có những đặc điểm vật lý – hóa học làm gia tăng đáng kể khả năng tương tác với hệ thống sinh học. Theo Andre Nel et al. (2006) [1], kích thước nhỏ, diện tích bề mặt lớn, tính hòa tan và khả năng sinh ra gốc oxy hóa mạnh (ROS) là các yếu tố chủ chốt quyết định độc tính của nanoparticle. Khi kích thước vật liệu càng nhỏ, tỷ lệ các nguyên tử bề mặt trên toàn khối càng cao, từ đó làm tăng hoạt tính hóa học và khả năng phản ứng với môi trường tế bào.
Ngoài ra, hình dạng và lớp phủ bề mặt của nanoparticle cũng ảnh hưởng đến mức độ hấp thụ, phân bố, chuyển hóa và bài tiết (ADME) trong cơ thể. Chẳng hạn, các hạt nano hình sợi như carbon nanotubes (CNTs) có thể tương tác với tế bào theo cách giống sợi amiăng, dẫn đến viêm mạn tính và tổn thương mô [1].
Vật liệu nano (nanomaterials – NMs), nhờ kích thước nhỏ bé (1–100 nm), có khả năng tương tác sâu sắc với các hệ thống sinh học. Tuy nhiên, chính những đặc tính độc đáo này cũng dẫn đến các cơ chế gây độc phức tạp, ảnh hưởng đến sức khỏe con người.
1. Tạo ra stress oxy hóa (Oxidative stress)
Một trong những cơ chế chính gây độc của vật liệu nano là sự tạo thành các loại phản ứng oxy hóa (ROS – Reactive Oxygen Species) như superoxide (O₂⁻), hydroxyl radical (•OH) và hydrogen peroxide (H₂O₂). ROS có thể phá vỡ cấu trúc màng tế bào, tổn thương DNA, protein và lipid, dẫn đến rối loạn chức năng tế bào và thậm chí chết tế bào theo chương trình (apoptosis) hoặc hoại tử.
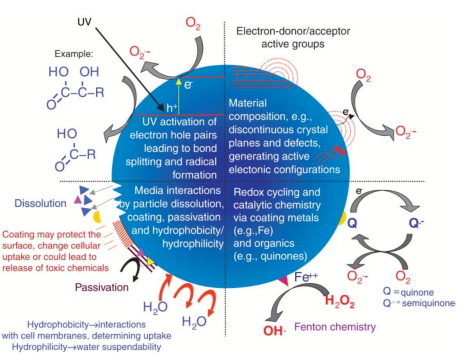
Hình 3.1. Các cơ chế vật liệu nano có thể tương tác với mô sinh học
Hình 2.4 minh họa tầm quan trọng của thành phần vật liệu, cấu trúc điện tử, các loài bề mặt liên kết (ví dụ, chứa kim loại), lớp phủ bề mặt (chủ động hoặc thụ động) và độ hòa tan, bao gồm sự đóng góp của các loài bề mặt và lớp phủ và tương tác với các yếu tố môi trường khác (ví dụ, hoạt hóa UV).
Các vật liệu nano kim loại như TiO₂, ZnO, AgNPs thường liên quan chặt chẽ đến cơ chế này. Ví dụ, nghiên cứu của Nel et al. (2006) cho thấy nanoparticle TiO₂ có thể kích thích sinh ROS mạnh trong tế bào phổi người, dẫn đến viêm và tổn thương mô phổi [1].
Nghiên cứu này phân tích tiềm năng gây độc của vật liệu nano (nanomaterials – NMs), nhấn mạnh rằng những đặc tính vật lý–hóa học độc đáo của chúng, như kích thước siêu nhỏ, diện tích bề mặt lớn, thành phần hóa học, và cấu trúc bề mặt, có thể gây ra các tác động bất lợi lên hệ sinh học, đặc biệt là thông qua cơ chế stress oxy hóa. Tác giả đề xuất một mô hình phân tầng ("hierarchical model") để đánh giá độc tính của vật liệu nano dựa trên mức độ stress oxy hóa mà chúng gây ra.
a. Khái niệm
Stress oxy hóa (oxidative stress) xảy ra khi sự sản sinh các loại phản ứng oxy hóa (ROS) vượt quá khả năng trung hòa của hệ thống chống oxy hóa nội sinh, như glutathione (GSH) hoặc các enzyme bảo vệ (catalase, superoxide dismutase, peroxidase). Điều này dẫn đến tổn thương tế bào và mô.
b. Nguồn gốc ROS từ vật liệu nano
Vật liệu nano có thể tạo ra ROS nhờ các cơ chế sau:
- Tăng diện tích bề mặt: Khi giảm kích thước sẽ làm tăng số lượng nguyên tử bề mặt dẫn đến tăng hoạt tính hóa học.
- Tạp chất kim loại chuyển tiếp: Như Fe, V hoặc Mn trên bề mặt vật liệu (ví dụ CNTs, carbon black) tham gia phản ứng Fenton từ đó sinh ra •OH.
- Nhóm chức bề mặt có tính oxy hóa–khử: Như nhóm quinone trên các hạt carbon gây tạo ROS.
- Ảnh hưởng từ ánh sáng UV hoặc tương tác với O₂: Dẫn đến tạo superoxide (O₂•⁻) và các ROS khác.
c. Mô hình stress oxy hóa phân tầng (Hierarchical oxidative stress model)
Andre Nel et al. đề xuất 3 mức phân tầng phản ứng sinh học theo mức độ stress oxy hóa, được thể hiện trong Hình 3.2 và Bảng 3.1.
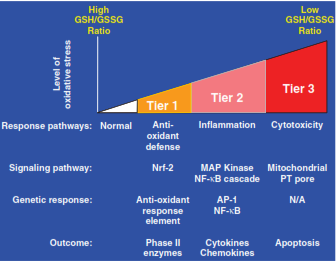
Hình 3.2. Ba mức phân tầng phản ứng sinh học theo mức độ stress oxy hóa
|
Tầng |
Mức stress oxy hóa |
Phản ứng sinh học chủ đạo |
|
Tier 1 |
Thấp |
Tăng cường enzyme chống oxy hóa thông qua kích hoạt yếu tố phiên mã Nrf2 và các gene pha II (ví dụ: HO-1, GST, NQO1) dẫn tới phục hồi cân bằng GSH/GSSG. |
|
Tier 2 |
Trung bình |
Kích hoạt các tín hiệu gây viêm, như MAPK, NF-κB làm tăng biểu hiện cytokine (IL-6, TNF-α) dẫn tới viêm cấp/mạn tính. |
|
Tier 3 |
Cao |
Rối loạn ty thể dẫn tới mở lỗ thấm màng ty thể (PT pore), giải phóng cytochrome c, hoạt hóa caspase làm chết tế bào theo chương trình (apoptosis) hoặc hoại tử (necrosis). |
d. Hệ quả sinh học của stress oxy hóa do vật liệu nano
- Viêm cấp và mạn tính ở phổi (vì là cửa ngõ phơi nhiễm chính)
- Tổn thương DNA và ty thể, đột biến gen → nguy cơ ung thư
- Thay đổi biểu hiện gene, mất điều hòa phân bào
- Tác động hệ miễn dịch, có thể dẫn đến rối loạn miễn dịch hoặc tự miễn
- Phá vỡ màng tế bào, tổn thương lipid và protein màng
Stress oxy hóa là một paradigm trung tâm trong độc học nano. Việc đánh giá khả năng sinh ROS và các dấu hiệu stress oxy hóa được xem là tiêu chuẩn dự đoán độc tính sớm của vật liệu nano, với các chỉ dấu sinh học bao gồm: tăng men chống oxy hóa, lipid peroxidation, biểu hiện cytokine tiền viêm, apoptosis do ty thể.
2. Gây viêm và phản ứng miễn dịch
Vật liệu nano khi xâm nhập vào cơ thể qua đường hô hấp, da hoặc tiêu hóa có thể tương tác với tế bào miễn dịch (macrophage, neutrophil), kích thích sản sinh các cytokine gây viêm như IL-1β, IL-6, TNF-α, góp phần vào các phản ứng viêm mạn tính.
Trong một nghiên cứu của Polan và cộng sự (2008) trên chuột, ống nano carbon (CNTs) khi được hít vào phổi gây ra viêm phế nang và xơ hóa mô phổi giống như tác dụng của asbestos, một chất gây ung thư đã biết [3].
Nghiên cứu này nhằm đánh giá khả năng gây viêm của ống nano carbon nhiều lớp (MWCNTs) bằng cách so sánh với asbestos (amiăng) – chất đã biết có thể gây bệnh lý như viêm phổi, xơ hóa và ung thư trung biểu mô.
Phương pháp thực hiện:
- Tiêm trực tiếp các mẫu MWCNTs có độ dài khác nhau vào khoang bụng chuột (intraperitoneal injection).
- Đánh giá phản ứng viêm sau 24 giờ và 7 ngày: đếm bạch cầu trung tính (PMN), mức protein dịch rửa màng bụng, hình thành granuloma và tế bào khổng lồ (FBGCs).
Kết quả cho thấy:
- Chỉ những mẫu MWCNT dài (>20 μm) mới gây ra: phản ứng viêm cấp mạnh (tăng PMN và protein), hình thành granuloma và tế bào khổng lồ sau 7 ngày.
- Mẫu ngắn hoặc dạng rối (tangled) không gây viêm đáng kể.
- Cơ chế giống amiăng: các sợi dài khó bị thực bào hoàn toàn, gây “thực bào thất bại” (frustrated phagocytosis), dẫn đến viêm mạn tính.
Như vậy, các MWCNT dài, có dạng sợi cứng, có độc tính dạng sợi giống asbestos, với khả năng gây viêm, hình thành tổn thương hạt (granuloma) và có thể gây ung thư trung biểu mô. Tính chất gây độc phụ thuộc vào hình dạng và độ dài, không chỉ thành phần hóa học.
Cơ chế gây độc do viêm và phản ứng miễn dịch trải qua 3 bước.
a. Khởi phát viêm do thực bào thất bại (Frustrated phagocytosis)
Thực bào (tiếng Anh: phagocytosis) là một quá trình sinh học trong đó tế bào miễn dịch, chủ yếu là đại thực bào (macrophages) và bạch cầu trung tính (neutrophils), nhận diện, bao vây, nuốt và tiêu hóa các vật thể lạ như: vi khuẩn, virus; tế bào chết hoặc tổn thương; dị vật (ví dụ: bụi mịn, vật liệu nano…).
Cơ chế của quá trình thực bào gồm 4 bước chính:
- Nhận diện: Tế bào miễn dịch nhận ra vật thể lạ nhờ các thụ thể trên bề mặt màng tế bào (ví dụ: thụ thể Fc, thụ thể bổ thể).
- Tiếp xúc và bao vây: Màng tế bào kéo dài tạo nên các "cánh tay" (pseudopodia) bao quanh vật lạ.
- Hình thành túi thực bào (phagosome): Vật thể bị bao bọc hoàn toàn trong một túi màng bên trong tế bào.
- Tiêu hóa: Túi thực bào hòa nhập với lysosome (chứa enzyme tiêu hóa) tạo thành phagolysosome, nơi vật thể bị phân giải.
Ý nghĩa của thực bào
- Bảo vệ cơ thể: Loại bỏ tác nhân gây bệnh, tế bào chết, dị vật.
- Kích hoạt đáp ứng miễn dịch: Giải phóng cytokine báo hiệu nguy hiểm.
- Dọn dẹp mô: Hồi phục mô bị tổn thương sau viêm hoặc nhiễm trùng.
Thực bào thất bại và hậu quả: Khi vật thể quá lớn hoặc quá dài (như ống nano carbon dài hoặc sợi amiăng), đại thực bào không thể nuốt trọn được gọi là hiện tượng thực bào thất bại (frustrated phagocytosis).
Hệ quả: Đại thực bào liên tục tiết ra các chất gây viêm như ROS, TNF-α, IL-1β. Kéo dài phản ứng viêm, dễ dẫn đến tổn thương mô, xơ hóa và thậm chí ung thư.
Các đại thực bào cố gắng bao vây và nuốt các sợi MWCNT dài. Khi chiều dài của sợi vượt quá khả năng bao bọc của đại thực bào (>15–20 μm), quá trình thực bào bị thất bại.
Điều này gây kích hoạt mạnh đại thực bào, dẫn đến giải phóng hàng loạt các chất trung gian gây viêm:
- Cytokine: TNF-α, IL-1β, IL-6
- Gốc tự do ROS
- Enzyme tiêu hủy mô (như protease, elastase)
Hệ quả là viêm cấp tính và tổn thương mô tại chỗ.
b. Hình thành granuloma và tế bào khổng lồ (FBGCs)
Tình trạng viêm kéo dài và không loại bỏ được vật liệu nano kích hoạt sự hợp nhất của đại thực bào tạo thành tế bào khổng lồ đa nhân (FBGCs).
Các FBGCs và đại thực bào tích tụ xung quanh sợi MWCNT tạo thành granuloma – một tổn thương hạt giống như trong nhiễm trùng lao hoặc tiếp xúc asbestos.
Bên trong granuloma: có hiện tượng xơ hóa và tích tụ collagen, có thể dẫn đến xơ cơ quan và mất chức năng.
c. Viêm mãn tính và nguy cơ ung thư
Nếu tiếp xúc kéo dài, phản ứng viêm sẽ duy trì ở mức thấp nhưng liên tục sẽ dẫn đến viêm mạn tính. Các cytokine tiền viêm và ROS có thể gây:
- Tổn thương DNA, đột biến gen.
- Tăng sinh tế bào không kiểm soát, góp phần vào quá trình ung thư hóa.
Tác giả cũng đã chứng minh phản ứng viêm không đến từ kim loại nặng hoặc endotoxin lẫn trong mẫu. Hình dạng sợi dài và độ bền sinh học cao là yếu tố quyết định chính.
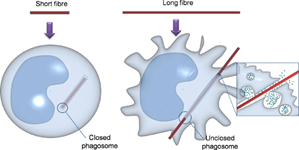
Hình 3.3. Cơ chế thực bào và thực bào thất bại
3. Tác động đến hệ gene và biểu hiện gene
NMs có thể xâm nhập vào nhân tế bào và tương tác trực tiếp với DNA hoặc can thiệp gián tiếp thông qua ROS, gây ra đột biến gene, đứt gãy DNA, thay đổi biểu hiện gene và epigenetic. Điều này có thể dẫn đến ung thư hoặc rối loạn chuyển hóa.
Ví dụ, nghiên cứu của AshaRani et al. (2009) chứng minh rằng bạc nano (AgNPs) có thể làm hư hỏng DNA và ức chế phân bào trong tế bào người, làm giảm tốc độ sinh trưởng và tăng tỉ lệ chết tế bào [4].
Nghiên cứu đánh giá độc tính tế bào (cytotoxicity) và độc tính di truyền (genotoxicity) của nanoparticles bạc bọc tinh bột (Ag-np) trên hai dòng tế bào người: IMR-90 (tế bào phổi bình thường), U251 (tế bào ung thư não glioblastoma).
Phát hiện chính: Ag-np gây giảm ATP, giảm hoạt động ty thể, sản sinh ROS phụ thuộc liều lượng; tổn thương DNA được ghi nhận bằng comet assay và micronucleus assay, đặc biệt nghiêm trọng hơn ở tế bào ung thư.
Ag-np xâm nhập vào ty thể và nhân tế bào, gây ra tổn thương DNA, dừng chu kỳ tế bào ở pha G2/M, nhưng không gây chết tế bào hàng loạt.
Đề xuất cơ chế: Ag-np → phá vỡ chuỗi hô hấp ty thể → ROS → tổn thương DNA → dừng chu kỳ → nếu không sửa được → chết tế bào muộn.
Cơ chế tác động đến hệ gene và biểu hiện gene:
a. Gây tổn thương DNA trực tiếp và gián tiếp
Gián tiếp thông qua ROS: Ag-np gây sản sinh mạnh các loại ROS như superoxide (O₂⁻•), hydrogen peroxide (H₂O₂), và hydroxyl radical (•OH). ROS gây oxy hóa base DNA (ví dụ: tạo 8-hydroxyguanine) và gãy mạch đơn hoặc kép trong phân tử DNA.
Trực tiếp qua xâm nhập nhân: TEM cho thấy Ag-np xâm nhập vào nhân và nucleolus. Các hạt hoặc ion bạc (Ag⁺) có thể liên kết với N7 của guanine/adenine, gây đột biến hoặc ngăn cản quá trình phiên mã.
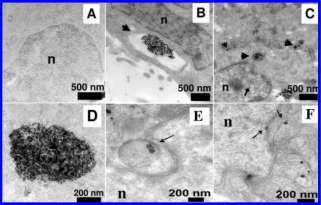
Hình 3.4. Hình ảnh TEM của các phần tế bào siêu mỏng
Các tế bào chưa được xử lý không có bất thường nào (A), trong khi các tế bào được xử lý bằng Ag-np cho thấy các thể nội bào lớn gần màng tế bào với nhiều hạt nano bên trong (B). Ảnh chụp bằng kính hiển vi điện tử cho thấy các thể lysosome có các hạt nano bên trong (mũi tên dày) và nằm rải rác trong tế bào chất (mũi tên mở). Mũi tên kim cương cho thấy sự hiện diện của hạt nano trong nhân (C). Hình ảnh phóng to của các nhóm nano cho thấy cụm này bao gồm các hạt nano riêng lẻ chứ không phải các khối (D). Hình ảnh cho thấy các thể nội bào trong tế bào chất nằm trong các chỗ lõm của màng nhân (E) và sự hiện diện của các hạt nano trong ty thể và trên màng nhân (F).
b. Gây ra đột biến và bất thường nhiễm sắc thể
Comet assay (hay còn gọi là phép thử đuôi sao chổi, tiếng Việt thường gọi là xét nghiệm sao chổi) là một kỹ thuật sinh học phân tử dùng để phát hiện và định lượng tổn thương DNA ở mức tế bào đơn lẻ): Ag-np gây tăng chiều dài đuôi DNA, cho thấy có nhiều tổn thương mạch DNA.
Cytokinesis-blocked micronucleus assay (CBMN, là một kỹ thuật sinh học phân tử dùng để đánh giá độc tính di truyền (genotoxicity), đặc biệt là khả năng gây đột biến nhiễm sắc thể của các tác nhân như vật liệu nano, thuốc, hóa chất, bức xạ, v.v.): Ghi nhận sự xuất hiện của nhân phụ (micronuclei) do các mảnh nhiễm sắc thể bị gãy không kịp tham gia phân chia.
c. Dừng chu kỳ tế bào ở pha G2/M
Khi DNA bị tổn thương, tế bào kích hoạt checkpoint G2/M, ngăn phân chia để sửa chữa.
Quan sát bằng flow cytometry cho thấy tế bào tích tụ ở pha G2/M rõ rệt, đặc biệt ở liều cao Ag-np.
Việc dừng chu kỳ không kèm theo chết tế bào hàng loạt chứng tỏ tế bào đang cố gắng sửa chữa DNA, nếu thất bại, sẽ chết theo chu trình hoặc trở thành tế bào đột biến.
d. Giảm biểu hiện gene và ảnh hưởng cơ chế sửa chữa
Giảm ATP nội bào do tổn thương ty thể, ảnh hưởng đến hoạt động của enzyme sửa DNA (nhiều enzyme cần ATP để hoạt hóa).
Nghiên cứu còn dẫn các nghiên cứu ở vi khuẩn: Ag⁺ gây giảm biểu hiện protein ribosome S2, enzyme CoA synthetase, giảm tổng hợp protein và năng lượng, cản trở phiên mã và sửa chữa gene.
Ag-np có thể khai thác làm tác nhân chống tăng sinh tế bào ung thư, nhờ khả năng gây dừng chu kỳ và tổn thương DNA chọn lọc. Tuy nhiên, tác hại tương tự cũng xảy ra ở tế bào lành, nên cần kiểm soát liều lượng và thời gian phơi nhiễm trong các ứng dụng y học.
4. Xâm nhập và tích lũy sinh học (Bioaccumulation)
NMs có thể xuyên qua hàng rào sinh học như hàng rào máu–não (blood-brain barrier), nhau thai và đường tiêu hóa. Khi đi vào các cơ quan như gan, thận, não, NMs có thể tích lũy và gây độc mãn tính, làm suy giảm chức năng cơ quan.
Chen et al. (2006) cho thấy nano-copper tích lũy trong thận và lá lách chuột gây viêm và tổn thương mô kéo dài [5].
Nghiên cứu này đánh giá và so sánh độc tính cấp tính của: Nano-copper (kích thước 23.5 nm); Micro-copper (17 µm); Ion đồng (Cu²⁺) ở chuột qua đường tiêu hóa.
Phương pháp thực hiện là tiêm qua đường miệng nhiều liều khác nhau.
Để có thể xác định mức độ ảnh hưởng của các tác chất, các tác giả đã theo dõi các chỉ số:
- LD₅₀ (Lethal Dose 50%): là liều gây chết trung bình cho 50% quần thể sinh vật thử nghiệm, thường được tính theo đơn vị mg/kg trọng lượng cơ thể.
- Biến đổi hình thái và mô học
- Chỉ số sinh hóa máu (BUN, creatinine, ALP, TBA)
Kết quả chính mà nghiên cứu đạt được:
- LD₅₀ nano-copper = 413 mg/kg ở mức độc tính trung bình
- LD₅₀ micro-copper > 5000 mg/kg, hầu như không độc
- Nano-copper gây tổn thương rõ ở thận, gan, lách, dẫn đến hoại tử, thoái hóa, viêm cầu thận, atrophy của lách.
- Chỉ số BUN và creatinine tăng mạnh ở nhóm nano, tổn thương thận.
- Chuột đực chịu độc nặng chuột cái, độc tính phụ thuộc giới tính.

Hình 3.5. Thận của chuột thí nghiệm ở nhóm liều M3 (1077 mg/kg) (a); N7 (1080 mg/kg) (b) và nhóm đối chứng (c)
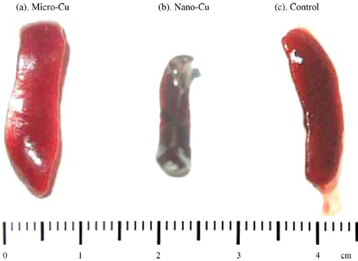
Hình 3.6. Lá lách của chuột thí nghiệm ở nhóm liều M3 (1077 mg/kg) (a); N7 (1080 mg/kg) (b) và nhóm đối chứng (c)
Cơ chế xâm nhập và tích lũy sinh học được các tác giả giải thích như sau:
a. Cơ chế xâm nhập qua đường tiêu hóa
Nano-copper có khả năng xâm nhập mạnh vào cơ thể do:
- Kích thước siêu nhỏ (23.5 nm) có thể vượt qua hàng rào niêm mạc ruột.
- Tế bào M tại mảng Peyer trong mô lympho ruột (Peyer’s patches) có khả năng thực bào các hạt nano, từ đó xâm nhập vào hệ bạch huyết và máu.
- Tăng tính thực bào tại niêm mạc tiêu hóa, gây phản ứng miễn dịch hoặc viêm mạn.
b. Phân bố sinh học (Biodistribution)
Sau khi xâm nhập, nano-copper di chuyển theo hệ bạch huyết đến máu ngoại vi, sau đó phân bố rộng rãi đến gan (hệ thống thực bào mô liên kết – RES), lách (trung tâm miễn dịch và lọc máu), thận (thải độc kim loại)
c. Tích lũy và gây độc cơ quan đích
Nano-copper không bị phân giải nhanh, dẫn đến:
- Tích tụ trong ống thận, gây viêm cầu thận, thoái hóa biểu mô ống lượn gần, tăng creatinine và BUN.
- Tích tụ ở gan, gây thoái hóa mỡ (steatosis), tăng ALP, TBA.
- Tích tụ ở lách, gây teo tủy lách, giảm lympho bào, làm tổn thương miễn dịch.
d. Vai trò của diện tích bề mặt và số lượng hạt
Diện tích bề mặt và số lượng hạt cũng ảnh hưởng không nhỏ đến khả năng tiếp xúc và tích lũy sinh học.
|
Thông số |
Micro-Cu (17 µm) |
Nano-Cu (23.5 nm) |
|
Diện tích bề mặt |
3.99 × 10² cm²/g |
2.95 × 10⁵ cm²/g |
|
Số hạt trên 1 µg |
44 |
1.7 × 10¹⁰ |
Số lượng hạt càng nhiều, nhiều điểm tiếp xúc hơn, tăng khả năng tương tác với mô sống, gây phản ứng mạnh hơn.
Xâm nhập và tích lũy sinh học là cơ chế quan trọng trong độc tính của nano-copper. Khả năng vượt qua hàng rào sinh học, phân bố và tích tụ ở cơ quan đích gây nên tổn thương lan tỏa và phức tạp hơn so với các dạng hạt lớn hoặc ion. Điều này đặc biệt quan trọng với ứng dụng y học, thực phẩm, mỹ phẩm, vì đường tiêu hóa là cửa ngõ phổ biến nhất của phơi nhiễm nano.
Như vậy, cơ chế gây độc của vật liệu nano là tổng hợp của nhiều yếu tố sinh học và hóa học, trong đó stress oxy hóa đóng vai trò trung tâm, kéo theo hàng loạt hệ quả như viêm, tổn thương DNA, chết tế bào và rối loạn chức năng cơ quan. Cần có các nghiên cứu sâu hơn để đánh giá nguy cơ dài hạn và xây dựng các tiêu chuẩn an toàn khi sử dụng vật liệu nano trong y học, thực phẩm và công nghiệp.
TÀI LIỆU THAM KHẢO
[1] Nel A, Xia T, Mädler L, Li N. Toxic potential of materials at the nanolevel. Science (80- ) 2006;311:622–7. https://doi.org/10.1126/science.1114397.
[2] Camacho-murillo M, Obando-víquez M, Lilia S, Vega-baudrit JR. Toxicity of nanoparticles : A development opportunity in environment and health. J Clin Exp Toxicol 2022;6:1–6. https://doi.org/10.35841/2630-4570-6.5.001.
[3] Poland CA, Duffin R, Kinloch I, Maynard A, Wallace WAH, Seaton A, et al. Carbon nanotubes introduced into the abdominal cavity of mice show asbestos-like pathogenicity in a pilot study. Nat Nanotechnol 2008;3:423–8. https://doi.org/10.1038/nnano.2008.111.
[4] Asharani P V, Low G, Mun K, Hande MP, Valiyaveettil S. Cytotoxicity and genotoxicity of silver nanoparticles in human cells. ACS Nano 2009;3:279–90.
[5] Chen Z, Meng H, Xing G, Chen C, Zhao Y, Jia G, et al. Acute toxicological effects of copper nanoparticles in vivo. Toxicol Lett 2006;163:109–20. https://doi.org/10.1016/j.toxlet.2005.10.003.


